12-04-2022
El desarrollo y el lanzamiento de un nuevo medicamento o un dispositivo médico en el mercado son procesos bastante lentos y complejos. ¿Sabía que, a lo largo de todo el proceso, será necesario recurrir a algunos procedimientos lingüísticos?
De forma simplificada, el proceso global de producción y comercialización de un nuevo servicio o producto sanitario puede representarse a través del diagrama de la Figura 1.
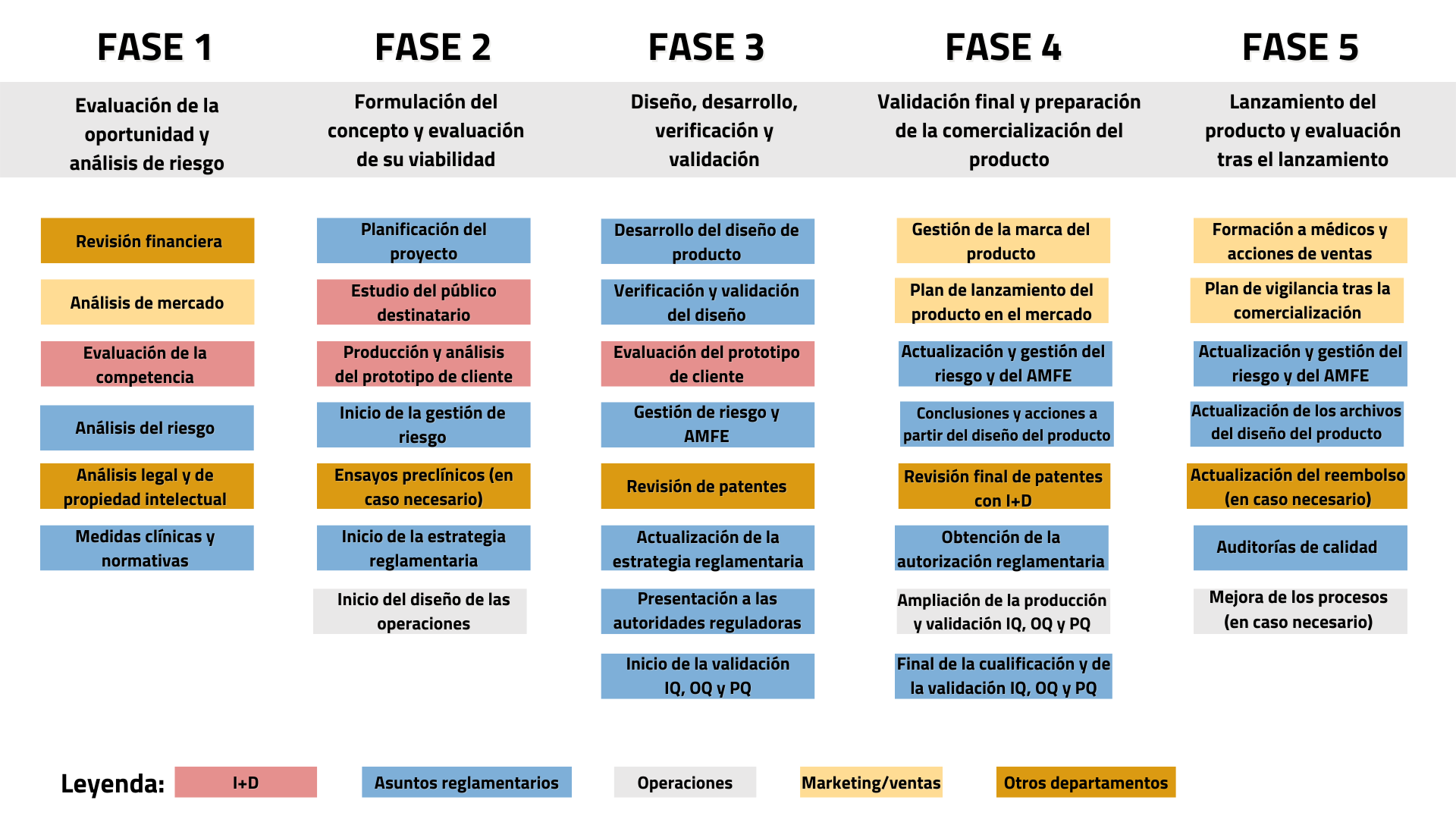
Figura 1: El desarrollo de un nuevo servicio o producto sanitario puede representarse en cinco pasos globales, desde la evaluación de la oportunidad y el análisis del riesgo, hasta el lanzamiento en el mercado y el análisis posterior al lanzamiento. Los servicios lingüísticos son necesarios en diversas etapas del proceso. Significado de las siglas: AMFE: Análisis Modal de Fallos y Efectos; IQ: Instalación y Cualificación; OQ: Cualificación Operativa; PQ: Cualificación de Rendimiento. Diagrama adaptado de Ashfaq A, 2018 1. |
En este artículo, le presentamos siete servicios lingüísticos que una empresa médica y farmacéutica puede necesitar para llegar al mercado con éxito.
La traducción médica y farmacéutica implica la interpretación de textos o documentos del ámbito médico y farmacéutico y la conversión subsiguiente de todo el mensaje a otro idioma.
Una empresa que desarrolla productos sanitarios, y que desee comercializarlos en Europa, necesita obtener el marcado CE para cada uno de ellos (Figura 2). Según el reglamento de la Unión Europea², el fabricante debe proporcionar el etiquetado y las instrucciones de utilización en el propio producto, en el envase y en el sitio web (si lo hay), así como la declaración de conformidad CE y el expediente técnico (obtenga toda la información detallada en este artículo). Cada país exige que la información sobre el producto sanitario esté redactada en el idioma del usuario local. Por tanto, para algunos productos puede ser necesario traducir estos documentos a 24 idiomas.

Figura 2: Etapas generales de las actividades en conformidad con la normativa europea para la fijación del marcado CE sobre productos sanitarios (adaptado de Freitas, A. S. B. Dispositivos Médicos: Enquadramento Regulamentar e Documentação Técnica²).
Cuando una CRO (siglas del inglés Contract Research Organization) lleva a cabo un ensayo clínico, necesita traducir una serie de documentos a los idiomas oficiales de cada participante, en especial consentimientos informados, protocolos clínicos, envases y etiquetados (para más información, consulte este artículo). En esta fase, es necesario llevar a cabo procesos de traducción farmacéutica.
2. Revisión y corrección por un hablante nativo
Dado que la traducción puede ser realizada por diferentes personas o entidades dentro de las empresas médicas o farmacéuticas, los documentos traducidos deben someterse a una verificación. Por tanto, la traducción efectuada por un profesional de una CRO o de la sucursal local, sin formación en traducción, debe ser revisada y corregida por un traductor nativo especializado en el campo de la salud, que domine la terminología científica y médica.
En ocasiones, el documento es redactado directamente en un determinado idioma por una persona que no es nativa como, por ejemplo, un artículo escrito en inglés para su publicación en revistas. En este caso, es necesario que una persona nativa de ese idioma con especialización en ese ámbito en cuestión efectúe la revisión. Obtenga más información sobre estos servicios aquí.
3. Adaptación lingüística local: localización
La localización lingüística consiste en ir más allá de la traducción del contenido de un documento a otro idioma y adaptarlo a las especificaciones sociales y culturales del mercado local. En la práctica, este servicio es relevante, por ejemplo, en las etapas de:
Presentación de los documentos reglamentarios a las autoridades reguladoras: cada país posee una normativa local propia para la venta y distribución de fármacos. Si algo no es conforme, puede provocar retrasos en la aprobación de las autoridades reguladoras, el aumento de los costes o incluso la repetición completa de un ensayo clínico
4. Validación lingüística
La validación lingüística consiste en evaluar la precisión del trabajo, desde el punto de vista del contenido y la cultura del país, a través de una examen realizado por personas nativas del idioma que viven en la región requerida.
En el sector médico, utilizar onzas o gramos, kilómetros o millas, puede marcar absolutamente la diferencia en la correcta comprensión del contenido. Las interpretaciones erróneas pueden tener graves consecuencias, de ahí que sea tan importante no subestimar este proceso, que técnicamente consta de tres etapas, como se representa en la Figura 3 (conozca todo el proceso en este artículo).
La validación lingüística puede exigirse a una CRO cuando se realizan ensayos clínicos. Algunos Comités de Ética exigen que los consentimientos informados se traduzcan de nuevo al idioma original, como una metodología de validación lingüística adicional para garantizar que el documento está debidamente traducido y adaptado al público destinatario, con el objetivo de evitar interpretaciones erróneas y problemas graves.
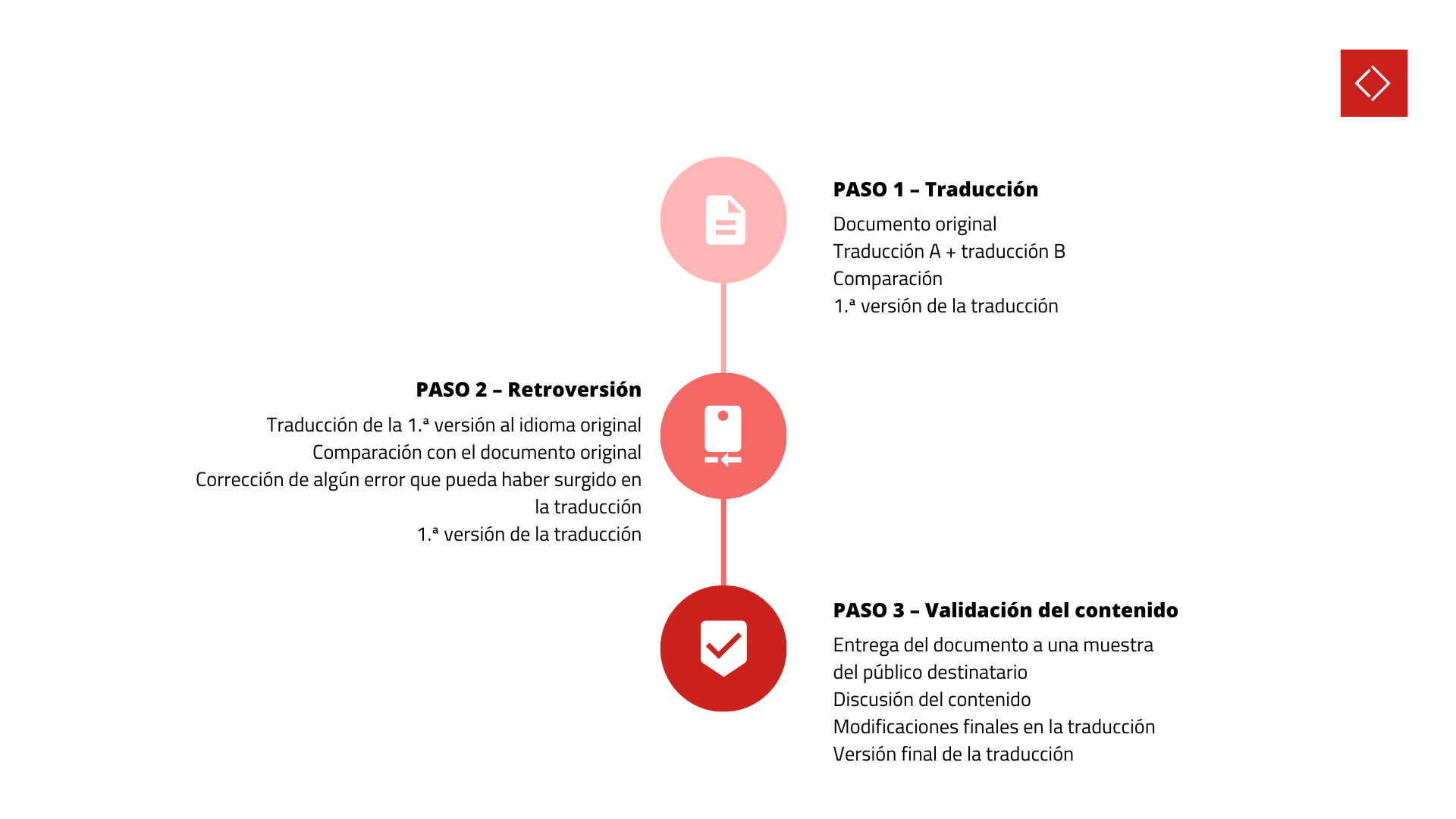
Figura 3: Etapas del proceso de validación lingüística.
|
5. Gestión terminológica
Cada sector o especialidad tiene su propio lenguaje. Si utilizamos dos términos diferentes para referirnos a un mismo concepto, ¿el lector se dará cuenta de que son términos sinónimos o pensará que estamos hablando a propósito de cosas diferentes? Vea el ejemplo: «La beta-talasemia se caracteriza por la deficiencia o la ausencia de la síntesis de la cadena de la beta-globulina. El diagnóstico de anemia de Cooley se basa en el análisis de hemoglobina». ¿El lector realmente entenderá que «beta-talasemia» y «anemia de Cooley» son sinónimos de la misma enfermedad?
Para evitar confundir al lector, es fundamental efectuar el proceso de gestión terminológica, que consiste en identificar, registrar y traducir al idioma deseado toda la terminología más específica e importante sobre el área de actuación de la empresa, el servicio o el producto.
6. Marketing internacional multilingüe
En la fase de lanzamiento de un nuevo producto médico o farmacéutico, son varios los materiales de comunicación y marketing que necesitan elaborarse, desde contenido para sitios web, folletos, anuncios web, manual de la marca, comunicación educacional y publicitaria para las redes sociales en formato escrito y audiovisual, comunicados de prensa y mucho más.
Un negocio que quiera ir más allá de sus fronteras debe reproducir estos materiales en la lengua materna del país en el que se comercializará el producto o servicio. En esta fase es necesario realizar un gran esfuerzo de marketing multilingüe, que es mucho más que una «simple» traducción de palabras. Es necesario garantizar que el mensaje es relevante para el país o el público en cuestión, trasladar las emociones a ese idioma y mantener la elevada calidad de comunicación en cualquier idioma.
7. Debugging de sitios web y software
Se trata de un proceso de control de calidad para detectar problemas de programación o gráficos en el sitio web de una empresa médica o farmacéutica o en el software de un producto sanitario, antes de su lanzamiento. Es posible detectar menús con errores lingüísticos, enlaces que no funcionan o que abren una página equivocada o imágenes que están en el idioma incorrecto.
¿Cómo proceder de forma práctica para realizar estos procesos?
Para ello, puede:
Referencias:
¹Ashfaq, A. Understanding the 5 phases of medical device development. Disponible en https://www.greenlight.guru/blog/5-phases-of-medical-device-development, 2018.
²Reglamento (UE) 2017/745 sobre productos sanitarios, disponible en https://eur-lex.europa.eu/eli/reg/2017/745/2017-05-05, consultado en septiembre de 2021.