12-04-2022
O desenvolvimento e o lançamento de um novo medicamento ou um dispositivo médico no mercado são processos bastante complexos e morosos. Sabia que, ao longo de toda a jornada será necessário recorrer a alguns procedimentos linguísticos?
De forma simplista, a jornada global de produção e comercialização de um novo serviço ou produto de saúde pode ser representada através do diagrama da Figura 1.
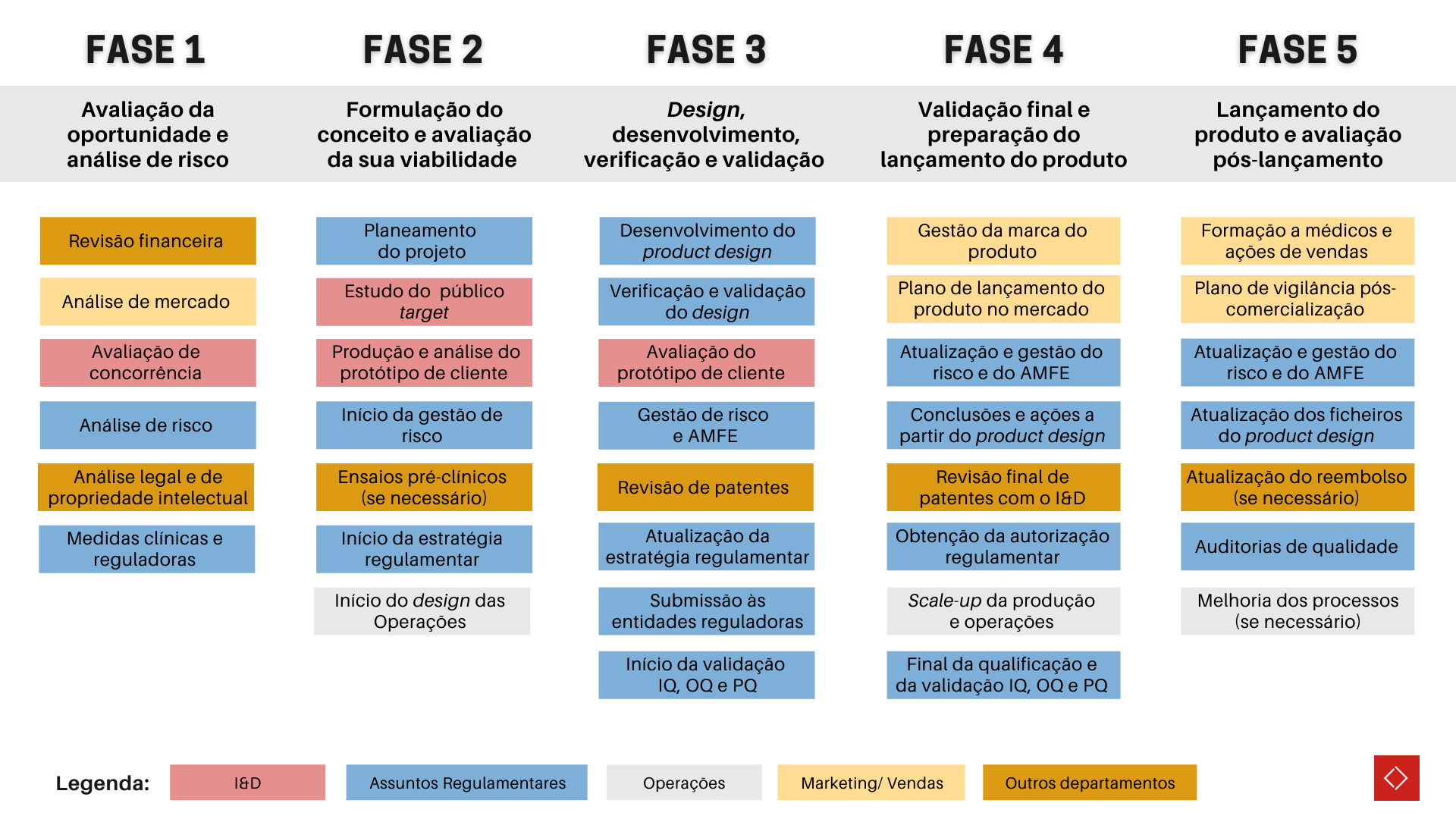
Figura 1: O desenvolvimento de um novo serviço ou produto de saúde pode ser representado por 5 passos globais, desde a avaliação da oportunidade e análise de risco, até ao lançamento no mercado e análise de pós lançamento. Os serviços linguísticos são necessários em diversas etapas do processo. Significado das siglas: AMFE – Análise Modal de Falhas e Efeitos; IQ – Instalação e Qualificação; OQ – Qualificação Operacional; PQ – Qualificação de Desempenho. Diagrama adaptado de Ashfaq A, 2018¹. |
Neste artigo, apresentamos-lhe sete serviços linguísticos que uma empresa farmacêutica e médica pode necessitar para alcançar o mercado com sucesso.
A tradução médica e farmacêutica envolve a interpretação de documentos ou textos da área médica e farmacêutica e a conversão subsequente de toda a mensagem para outra língua.
Uma empresa que desenvolva dispositivos médicos (DMs), e que pretenda comercializá-los na Europa, precisa de obter a marcação CE para cada um – Figura 2. Segundo o regulamento da União Europeia 2, o fabricante deve fornecer o rótulo e as instruções de utilização no próprio dispositivo, na embalagem e no website (caso exista), bem como a declaração de conformidade CE e o dossier técnico (veja todos os detalhes neste artigo). Cada país exige que as informações sobre o DM estejam redigidas no idioma do utilizador local. Assim, para alguns produtos pode ser necessário traduzir estas peças para 24 línguas.
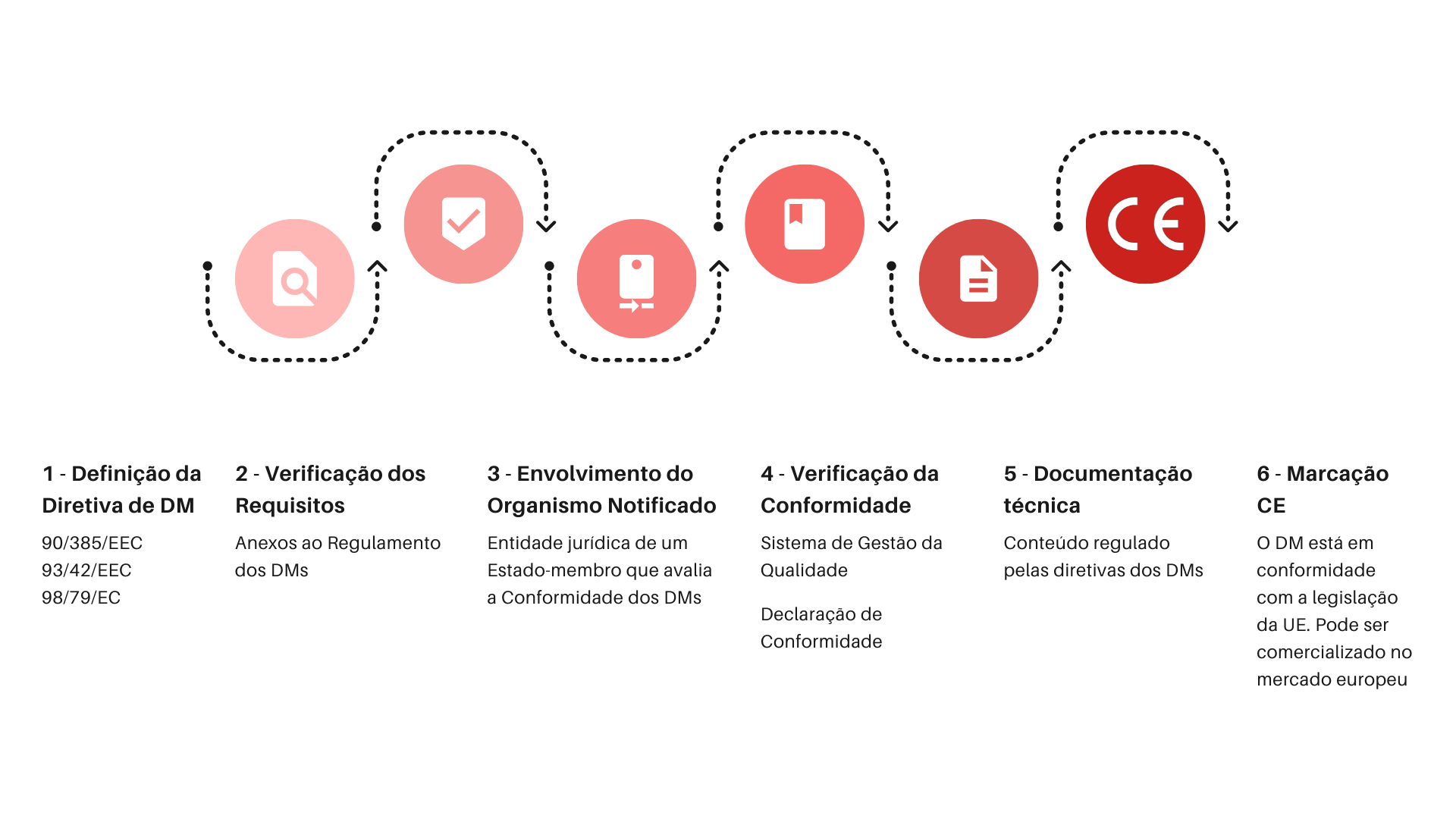
Figura 2: Etapas gerais das atividades em conformidade com a regulamentação europeia para a afixação da marcação CE em dispositivos médicos (adaptado de Freitas, A. S. B. Dispositivos Médicos: Enquadramento Regulamentar e Documentação Técnica²).
Quando uma CRO (do inglês, Contract Research Organization) conduz um ensaio clínico, necessita de uma série de documentos traduzidos para as línguas oficiais de cada participante, nomeadamente consentimentos informados, protocolos clínicos, embalagens e rótulos (para mais detalhes, consulte este artigo). É nesta fase que entra a necessidade de levar a cabo processos de tradução farmacêutica.
2. Revisão e correção por native speaker
Dado que a tradução pode ser realizada por pessoas ou entidades diferentes no seio das empresas médicas ou farmacêuticas, os documentos traduzidos devem ser sujeitos a uma verificação. Assim, a tradução feita por um profissional de uma CRO ou da sucursal local, sem formação em tradução, deve ser revista e corrigida por um tradutor nativo e especialista na área da saúde, que domina a terminologia científica e médica.
Por vezes, o documento é redigido diretamente numa determinada língua por uma pessoa que não é nativa, como, por exemplo um artigo escrito em inglês para publicação em revistas. Neste caso é necessário proceder à revisão por uma pessoa nativa desse idioma com especialização na área em questão. Saiba mais sobre estes serviços aqui.
3. Adaptação da linguagem ao local - localização
A localização da linguagem consiste em ir além da tradução do conteúdo de um documento para outra língua e adaptá-lo às especificações sociais e culturais do mercado local. Na prática, este serviço é relevante, por exemplo, nas etapas de:
4. Validação linguística
A validação linguística consiste em avaliar a precisão da tradução, do ponto de vista do conteúdo e da cultura do país, através de um exame realizado por pessoas nativas do idioma que vivem na região requerida.
No setor médico, utilizar onças ou gramas, quilómetros ou milhas, pode fazer toda a diferença na correta compreensão do conteúdo. Interpretações erradas podem resultar em consequências graves e por isso é que é tão importante não desvalorizar este processo que, tecnicamente, é composto por três etapas, como representado na Figura 3 (conheça todo o processo neste artigo).
A validação linguística pode ser exigida a uma CRO, aquando dos ensaios clínicos. Alguns Comités de Ética exigem que os Consentimentos Informados sejam traduzidos de novo para o idioma original, como uma metodologia de validação linguística extra para assegurar que o documento está devidamente traduzido e adaptado ao público a que se destina, com o objetivo de evitar interpretações erradas e problemas graves.
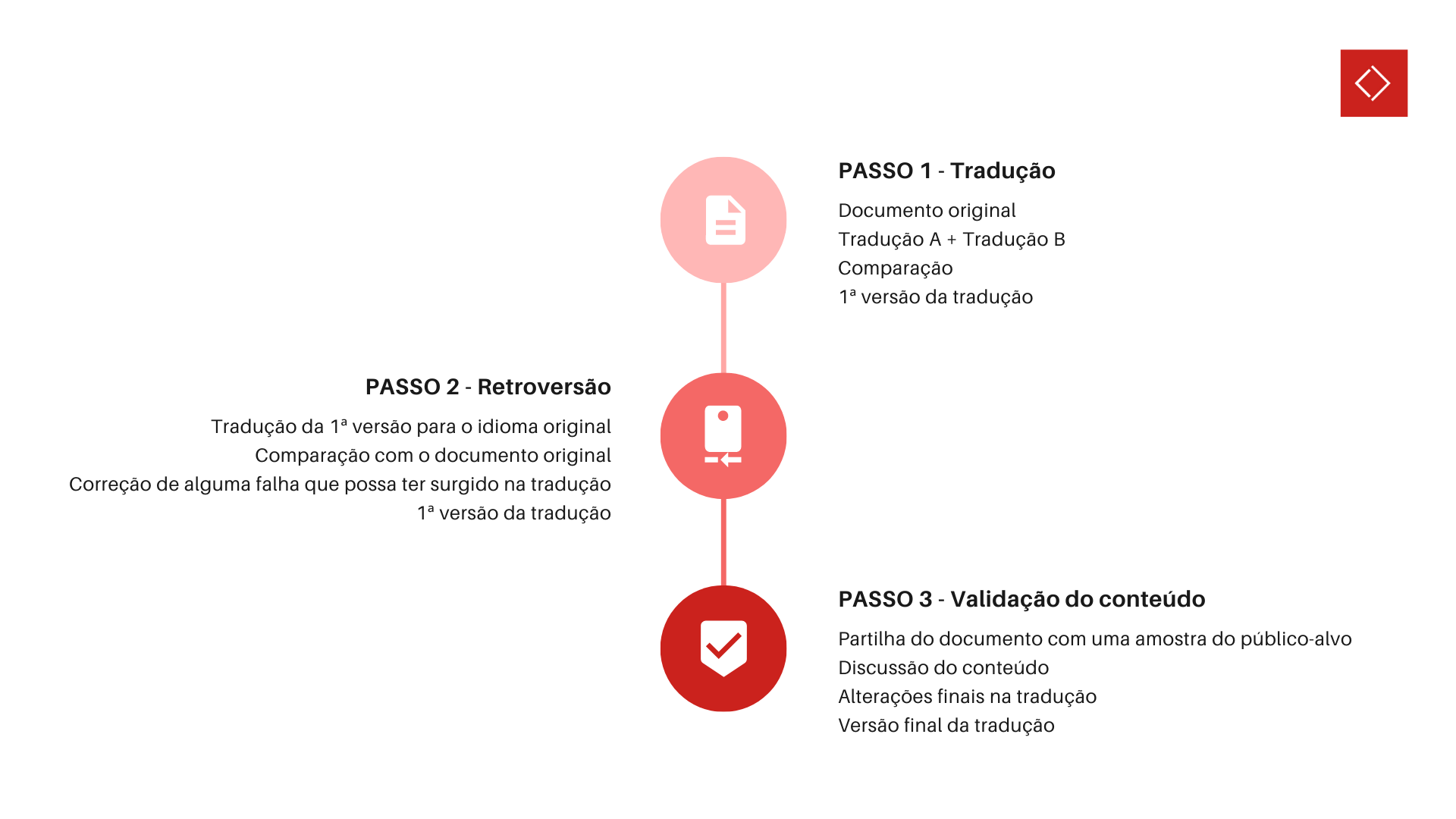 Figura 3: Etapas do processo de validação linguística. Figura 3: Etapas do processo de validação linguística. |
5. Gestão da terminologia
Cada setor/especialidade tem a sua linguagem própria. Se utilizarmos dois termos diferentes para nos referirmos a um mesmo conceito, será que a audiência irá perceber que estes são termos sinónimos ou que estamos a falar propositadamente de coisas diferentes? Veja o exemplo: “A beta-talassemia é marcada por deficiência ou ausência da síntese da cadeia da beta globulina. O diagnóstico da anemia de Cooley baseia-se na análise de hemoglobina.” Será que o leitor compreenderá que “beta-talassemia” e “anemia de Cooley” são sinónimos para a mesma doença?
Para evitar que a audiência fique confusa, é essencial levar a cabo o processo de gestão terminológica, que consiste em identificar, registar e traduzir para o idioma pretendido toda a terminologia mais específica e importante sobre a área de atuação da empresa, do serviço ou do produto (para mais detalhes, consulte este artigo).
6. Marketing Internacional Multilingue
Na fase de lançamento de um novo produto farmacêutico ou médico, vários são os materiais de Comunicação e Marketing necessários produzir, desde conteúdo para websites, brochuras, anúncios online, manual da marca, comunicação educacional e publicitária para as redes sociais em formato escrito e audiovisual, press releases para a imprensa, e muito mais.
Um negócio que queira ir além-fronteiras deve reproduzir estes materiais na língua materna do país no qual o produto ou o serviço será comercializado. É nesta fase que é necessário um grande esforço de Marketing Multilingue, que é muito mais do que uma “simples” tradução de palavras. É necessário garantir que a mensagem é relevante para o país ou a audiência em questão, transpor as emoções para essa língua, e manter a elevada qualidade de comunicação em qualquer idioma.
7. Debugging de websites e softwares
É um processo de controlo de qualidade para detetar problemas de programação ou gráficos no website de uma empresa médica ou farmacêutica ou no software de um dispositivo médico, antes do seu lançamento. É possível detetar menus com erros linguísticos, links que não funcionam ou que abrem uma página errada ou imagens que estão no idioma errado.
Como proceder de forma prática para que estes processos sejam realizados?
Para tal, pode:
Referências:
¹Ashfaq, A. Understanding the 5 phases of medical device development. Disponível em https://www.greenlight.guru/blog/5-phases-of-medical-device-development, 2018.
²Regulamento (EU) 2017/745 para Dispositivos Médicos, disponível em https://eur-lex.europa.eu/eli/reg/2017/745/2017-05-05, acedido em Setembro de 2021.